

Eigenschaften
Patientinnengruppe
Peri- und postmenopausale Frauen mit abnormalen Blutungen.
Verwendungszweck
Entscheidungshilfe für ÄrztInnen über die Notwendigkeit einer operativen histologischen Abklärung.
Testprinzip
WID®-easy ist ein epigenetischer PCR-Test, der den DNA-Methylierungsstatus zweier Regionen in den Genen GYPC und ZSCAN12 bestimmt.
Die Probennahme erfolgt mittels eines zervikovaginalen Abstrichs.
Leistungsparameter
Bedeutung
Erleichterung für die Patientin
Der WID®-easy Test verringert die Zahl der Frauen, die operative Diagnoseverfahren wie Hysteroskopie und Kürettage benötigen, obwohl sie keinen Krebs haben, um 95%.
Einsparung für das Gesundheitssystem
WID®-easy kann die Kosten für das Gesundheitssystem erheblich reduzieren.
Bei Frauen mit peri- und postmenopausalen Blutungen können 90 % der Kosten für Hysteroskopien, Ausschabung und die entsprechende Anästhesie eingespart werden.
Patientenbindung für den Gynäkologen
WID®-easy gibt dem/der niedergelassenen GynäkologIn die Sicherheit, dass im Fall von peri- oder postmenopausalen abnormalen Blutungen keine Malignität vorliegt.
Der/die ÄrztIn erspart der Patientin einen chirurgischen Eingriff im Krankenhaus und bleibt während der konservativen Behandlung in engem Kontakt mit ihr als deren primäre(r) AnsprechpartnerIn.
Wissenschaftliche Exzellenz
Das Vorgehen entsprechend den gültigen S3-Leitlinien ist nur im Fall eines positiven WID®-easy Tests erforderlich. Bei einem negativen WID®-easy Ergebnis kann die Operation vermieden werden.
Entsprechend den gültigen S3-Leitlinien zur Diagnostik, Therapie und Nachsorge der Patientinnen mit Endometriumkarzinom für Deutschland, die Schweiz und Österreich erfolgt die Abklärung von peri- und postmenopausalen Frauen mit abnormalen Blutungen durch Bestimmung der Endometriumsdicke mittels transvaginalem Ultrschall. Bei einer Endometriumsdicke > 3 mm ist eine operative histologische Abklärung mittels Gebärmutterspiegelung (Hysteroskopie) und Ausschabung (Abrasio) indiziert.
Dieses Vorgehen führt zu einer hohen Anzahl falsch positiver Ergebnisse, so dass sich viele Frauen ohne Endometriumkarzinom einer Hysteroskopie mit Ausschabung unterziehen müssen.
Die Anwendung des WID®-easy Tests senkt diese Rate falsch positiver Ergebnisse um ca. 95 %.
Wissenschaftliche Evidenz
Der WID®-easy-Test ist der beste nicht-invasive Test zur Erkennung von Endometriumkrebs und wird durch umfangreiche wissenschaftliche Daten gestützt.
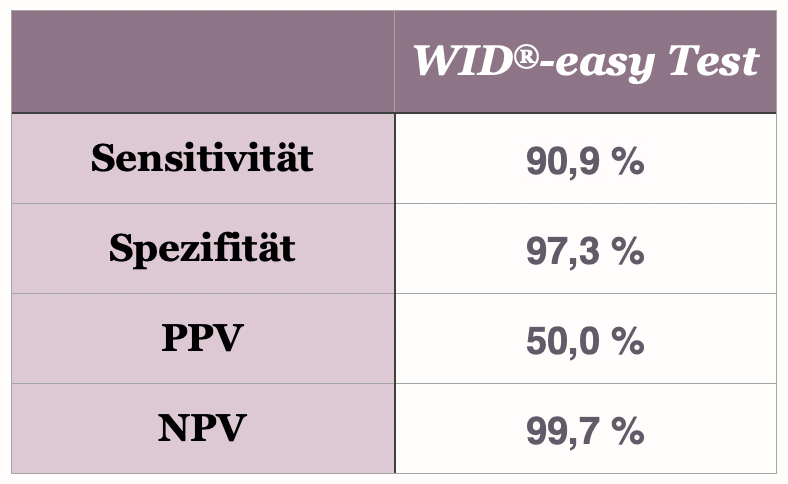
%
Sensititvität
%
Spezifität
%
Positiver Vorhersagewert (PPV)
%
Negativer Vorhersagewert (NPV)
Der direkte Vergleich zum Ultraschall
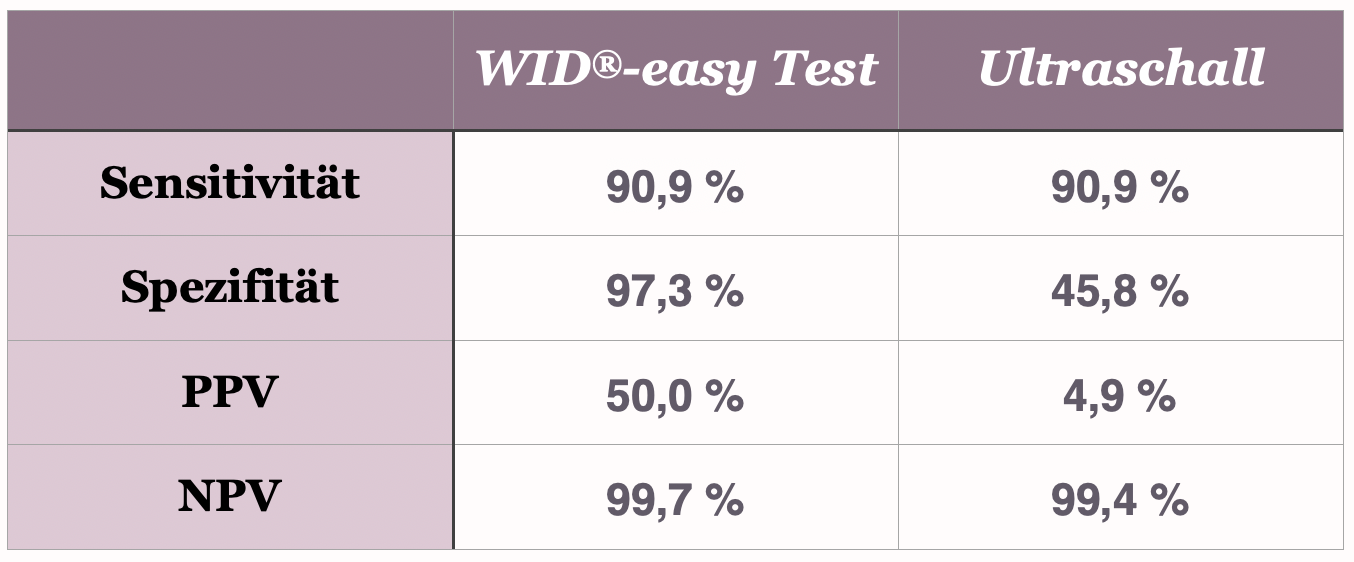
Der WID®-easy Test zeichnet sich durch extrem hohe Werte für Sensitivität (90,9 %), Spezifität (97,3 %) und den negativen Vorhersagewert (99,7 %) aus. Vor allem ist der positive Vorhersagewert (PPV) mit 50 % zehnmal höher als der der Ultraschalluntersuchung, dessen PPV nur 5 % beträgt (Evans et al., The Lancet Oncology, 2023).
Real-Life Vergleich zum Stand der Technik
In einer prospektiven Studie wurde die Leistung der aktuellen verbesserten Ausführung des WID-qEC Tests mit dem Standardverfahren im Vereinigten Königreich verglichen. Die Studie fand am UCL-Hospital in London statt.
400 Frauen im Alter ab 45 Jahren mit peri- oder postmenopausalen abnormalen Blutungen nahmen an der Studie teil.
Der WID-qEC Test reduziert die Zahl der Frauen, die chirurgische Diagnoseverfahren wie Hysteroskopie und Kürettage benötigen, obwohl sie keinen Krebs haben, um 87 % im Vergleich zum Standardverfahren in Großbritannien und um 95 % im Vergleich zum Standardverfahren in Deutschland, der Schweiz und Österreich.
Der WID-qEC Test beschleunigt die Diagnose bei Frauen mit Symptomen von Endometriumkrebs, was zu besseren Ergebnissen und Kosteneinsparungen im Gesundheitswesen führt.
Entwicklung und Validierung in fünf verschiedenen Settings
Diese Veröffentlichung beschreibt die Entwicklung und Validierung des WID-qEC Tests.
Der Test wurde anhand von 726 zervikovaginalen Abstrichen von Frauen mit und ohne Endometriumkarzinom entwickelt und in 562 davon unabhängigen zervikovaginalen Proben unter Verwendung von drei verschiedenen Entnahmemethoden und zwei diagnostischen sowie zwei prädiktiven Settings validiert.
Real-Life Kohorte und Validierung für Gebärmutterhalskrebs
WID-qEC Test wurde in einer real-Life Krankenhauskohorte von 304 Frauen validiert.
Darüber hinaus wurde in einer Case-Control-Studie die Überlegenheit des WID-qEC Test in der Detektion von Zervixkarzinom, v.a. endozervikaler Karzinome, gegenüber der zytologischen Untersuchung gezeigt.
Entwicklung der Hochdurchsatzanalytik
Der Artikel beschreibt die technische Umsetzung und die analytische Verifizierung des WID-qEC-Tests.
Der beschriebene Arbeitsablauf umfasst nicht nur die qPCR-Analyse selbst, sondern auch den gesamten Testprozess, einschließlich der Probenentnahme, der automatisierten DNA-Isolierung, Quantifizierung und Normalisierung und der automatisierten Bisulfit-Konvertierung sowie der nachgeschalteten Analyse und Dateninterpretation.
Dieser Prozess ermöglicht es den Labors, eine große Anzahl von Proben außergewöhnlich effizient zu verarbeiten.
Vergleich verschiedener Probenentnahmeverfahren
In der Studie wurde untersucht, ob unterschiedliche Probenentnahmeverfahren die Validität des Tests beeinflussen. Konkret wurden die Cervex-Bürste und PreservCyt mit dem FLOQSwab und eNAT, die von ÄrztInnen durchgeführte Probenentnahme mit der Selbstentnahme durch Patientinnen und unterschiedliche Entnahmestellen (vaginal, zerviko-vaginal oder zervikal) verglichen, um etwaigen Einfluss auf die Leistungsfähigkeit des Tests zu bewerten.
Die Ergebnisse zeigten, dass die Testeresultate unabhängig von der Entnahmemethode konstant blieben, selbst bei Proben, die sieben Tage lang bei Raumtemperatur gelagert wurden. Während die Selbstentnahme zu einer hohen Spezifität führte, war die Sensitivität etwas geringer.
Insgesamt bietet der WID-qEC-Test eine einfache, objektive und nicht-invasive Methode zur Bewertung des Malignitätsrisikos bei Frauen mit abnormen Blutungen.
Regulatorischer Hinweis
Der WID®-easy Test wird von Gesundheitseinrichtung, wie z.B. diagnostischen Laboratorien, entsprechend der europäischen In-Vitro-Diagnostik-Verordnung (IVDR) Artikel 5, Absatz 5 hergestellt und verwendet.
Geistige Eigentumsrechte
Die Durchführung und Vermarktung des WID®-easy Tests unterliegt den geistigen Eigentumsrechten des University College London („UCL“) und der Sola Diagnostics GmbH.
Die Marke „WID“ ist ein eingetragenes Markenrecht der Sola Diagnostics GmbH.
Die Rechte zur Durchführung und Vermarktung des WID®-easy Tests können von der Sola Diagnostics GmbH als Lizenz bzw. Sublizenz (im Fall der Rechte des UCL) erworben werden. Die Honorierung berechnet sich anhand der Anzahl von der Gesundheitseinrichtung abgerechneter Befundungen.




